- 작성일
- 2022.03.03
- 수정일
- 2022.03.03
- 작성자
- 화학과
- 조회수
- 3475
최정모 교수, 알츠하이머병 치료의 새로운 접근법 제시
최정모 교수, 알츠하이머병 치료의 새로운 접근법 제시
아미노산 서열 편집 통한 새로운 치매 치료법 제공 기대

화학과 최정모 교수 공동연구팀이 점 돌연변이*를 활용해 알츠하이머병을 유발하는 아밀로이드 베타**의 독성을 완화하는 데 성공했다.
* 점 돌연변이: 단백질의 전체 아미노산 서열 중 한 개가 바뀐 돌연변이.
** 아밀로이드 베타: 알츠하이머병 환자의 뇌에서 발견되는 병원성 아밀로이드 섬유 응집체의 주성분 단백질.
최정모 교수팀은 최근 고려대 김준곤 교수팀과 함께 아밀로이드 베타의 초기 상호작용을 방해해 단백질 응집체 형성을 억제하고 세포 독성을 완화하는 점 변이체를 설계했다.
기존의 알츠하이머병 치료는 주로 증상 완화를 목적으로 하는 대증요법 중심으로 진행돼 왔다.
최근에는 근본적인 치료를 목적으로 알츠하이머병의 주요 표지 물질인 아밀로이드 베타의 섬유 응집체와 타우 단백질*의 신경섬유 엉킴을 표적으로 하는 연구가 활발히 진행되고 있다.
* 타우 단백질: 아밀로이드 베타와 함께 알츠하이머병 환자의 뇌에서 발견되는 주요 표지 단백질로, 신경섬유 엉킴의 주성분 단백질. 아밀로이드 베타는 타우 단백질의 신경섬유 엉킴과 연관돼 있는 것으로 알려져 있다.
연구팀은 아밀로이드 베타가 응집 과정에서 다양한 형태로 존재하는 점을 고려해 특정 상태를 표적으로 하지 않고 단백질의 점 변이체와의 상호작용을 통해 병원성 응집체 형성을 억제하는 새로운 접근법을 시도했다.
그 결과, 아밀로이드 베타 응집 과정에서 초기 상호작용의 핵심이 되는 단백질 영역을 규명하고, 단백질 상호작용을 저해할 수 있는 변이체를 설계해 실제 응집체 형성이 억제되고 세포 독성이 완화되는 것을 확인했다.
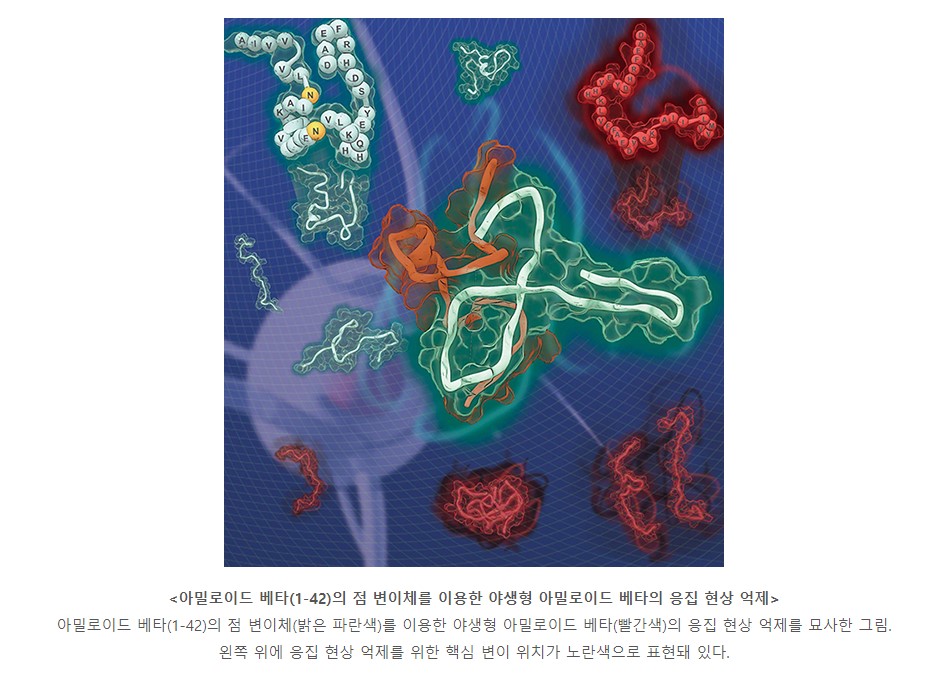
단백질 구조에 기반한 체계적인 설계를 통해 고안된 변이체를 이용, 병원성 비정형 단백질의 응집 현상을 저해하는 연구 방법론은 아밀로이드 베타뿐만 아니라 알파 시누클레인(파킨슨병 연관 단백질), 타우 등 다른 단백질의 구조를 이해하고 응집 현상을 제어하는 것에도 적용될 수 있을 것으로 기대된다.
또한, 이번 연구에서 설계된 변이체가 아밀로이드 베타의 독성을 완화한다는 사실을 세포 수준에서도 확인했다. 다만, 실제 임상에 활용하기 위해서는 더욱 고차원 실험 모델에서의 효과 및 안정성 검증이 필요하다.
과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구, 기초연구실 및 우수신진연구) 등의 지원으로 수행된 이번 연구의 성과는 화학 분야 국제학술지 『미국화학회지(Journal of the American Chemical Society)』 1월 24일자에 게재됐다.
- 논문 제목: Kinetic Modulation of Amyloid-β(1-42) Aggregation and Toxicity by Structure-Based Rational Design(구조기반 합리적 설계에 의한 아밀로이드-β(1-42) 응집 및 독성의 속도론적 조절)
- 논문 링크: https://doi.org/10.1021/jacs.1c10173
- 첨부파일
- 첨부파일이(가) 없습니다.